Licht hören
Warum Licht hören?
Laut einem Bericht der WHO leiden etwa 430 Millionen Menschen - über 5 % der Weltbevölkerung - an Schwerhörigkeit und bis 2050 werden voraussichtlich fast 700 Millionen Menschen eine Hörrehabilitation benötigen. Wenn herkömmliche Hörgeräte keine Abhilfe mehr schaffen, können Hörsignale durch Cochlea-Implantate direkt in neuronale Impulse im Hörnerv umgewandelt werden, wobei die gestörte Schallkodierung in der Cochlea umgangen wird. Diese "Sinnesprothese", die bereits in den 70er Jahren des 20. Jahrhunderts entwickelt wurde, wird von mehr als 700.000 hörgeschädigten Patienten genutzt und gilt als die erfolgreichste Neuroprothese der Welt. Sie nimmt den Schall über ein Mikrofon auf und wandelt ihn in Echtzeit in elektronische Signale um, wobei sie ihn in mehrere Kanäle aufteilt, die für unterschiedliche Frequenzbereiche kodieren. Die Informationen über die Schallintensität in jedem Frequenzkanal werden dann über 12 bis 24 Elektrodenkontakte, die entlang der tonotopischen Achse der Cochlea platziert sind, an die Hörneuronen weitergeleitet. Cochlea-Implantate ermöglichen den meisten Anwendern, Sprache zu verstehen. Allerdings leiden sie unter einer schlechten Qualität der Schallkodierung, da aufgrund der großen lateralen Ausbreitung des elektrischen Stroms von jedem der Elektrodenkontakte aus zu viele auditorische Neuronen in der Umgebung des Kontakts gleichzeitig stimuliert werden (Abb. 1). Daher ist die Anzahl der unabhängigen Kanäle sehr gering (typischerweise unter 10) und die Frequenz- und Lautstärkediskriminierung ist beim Hören mit Cochlea-Implantaten im Vergleich zum normalen Hören eher eingeschränkt. Dies schränkt die Fähigkeit, Sprache im Hintergrundgeräusch zu verstehen, musikalischen Melodien zu folgen oder den emotionalen Tonfall in Sprache zu interpretieren, stark ein.
 Abbildung 1: Schematische Darstellung der Funktion von Cochlea-Implantaten
Abbildung 1: Schematische Darstellung der Funktion von Cochlea-ImplantatenLinks: Aktuelles elektrisches Cochleaimplantat mit großer lateraler Ausbreitung der elektrischen Stimulation von jedem der 12 Elektrodenkontakte. Rechts: Zukünftiges optisches Implantat mit zahlreichen Emittern, deren Licht auf den Hörnerv fokussiert wird.
Da sich Licht wesentlich beser fokussieren lässt, könnte dieses grundsätzliche Problem gelöst werden, indem man Licht statt elektrischem Strom zur Stimulation der Neuronen verwendet. Jede Lichtquelle würde dann im Vergleich zum "elektrischen Hören" eine deutlich kleinere Gruppe von Zellen anregen (Abb. 1). Wenn Schallreize elektronisch in diskrete Frequenzbänder aufgespalten werden, können zukünftige Cochlea-Implantate diese Information über bis zu 100 unabhängige Stimulationskanäle mit mikroskaligen Lichtquellen übertragen. Dies verspricht eine deutliche Verbesserung der Unterscheidung von Tonhöhe und Lautstärke und damit einen Durchbruch bei der Wiederherstellung des Hörvermögens für hochgradig schwerhörige Menschen.
Wie können Nervenzellen das Licht hören?
Nervenzellen sind normalerweise nicht lichtempfindlich. Ernst Bamberg und Georg Nagel vom Max-Planck-Institut für Biophysik haben jedoch zusammen mit Peter Hegemann von der Humboldt-Universität zu Berlin eine Art von lichtempfindlichen Proteinen aus Grünalgen isoliert und charakterisiert, die als "Kanalrhodopsine" bezeichnet werden. Werden die Gene, die für diese Proteine kodieren, z.B. mit Hilfe von Viren als "Genfähren", in verschiedene Zellen übertragen, können sie als lichtgesteuerte "Schalter" zur Aktivierung der Zellen eingesetzt werden, ein Verfahren, das als "Optogenetik" bezeichnet wird. Spezifische Viren, die durch molekulare Modifikationen für den Zielorganismus unschädlich gemacht wurden, werden derzeit im Rahmen klinischer Studien zur Behandlung der angeborenen Blindheit eingesetzt. Wir können solche Viren verwenden, um die optogenetischen "Schalter" in die Hörnervenzellen einzubringen und sie so lichtempfindlich zu machen. Wir haben die Machbarkeit und Effizienz der Cochlea-Optogenetik bereits in mehreren Studien mit Nagern demonstriert. Mit einkanaliger Laserstimulation und mehrkanaliger Stimulation durch optische Cochlea-Implantate konnten wir das auditorische System auch bei tauben Tieren aktivieren, wie wir durch die Aufzeichnung von lichtevozierten auditorischen Hirnstammantworten zeigen konnten. Außerdem konnten wir zeigen, dass in der Tat eine begrenztere Population von Hörnervenzellen aktiviert wird, wenn wir Licht anstelle von elektrischem Strom als Aktivierungsreiz verwenden. Diese ist mit der Population vergleichbar, die durch einfache Schallreize aktiviert wird.
Was ist unser Ziel?
Abbildung 2: Zeitleiste der auditorischen Optogenetik-Forschung in Göttingen
Diese Methode wird nun verfeinert, um das Endziel einer klinischen Anwendung zu erreichen (Abb. 2). In Zusammenarbeit mit Optogenetikern haben wir Channelrhodopsine entwickelt, die für den Einsatz im Innenohr geeignet sind und die Stimulation von Neuronen unter möglichst physiologischen Bedingungen mit geringen Lichtintensitäten ermöglichen. Gefördert vom Europäischen Forschungsrat als Advanced Grant "OptoHear" hat das Institut für Auditorische Neurowissenschaften in Göttingen nun effiziente und sichere Möglichkeiten des Gentransfers in tierische Hörnervenzellen entwickelt, mit dem Ziel zukünftiger klinischer Studien an hochgradig gehörlosen Patienten. Im Rahmen des vom BMBF geförderten Projekts "Optical_CI" haben wir innovative flexible Mikro-LED-Cochlea-Implantate entwickelt, die eine optische Stimulation auch im Innenohr von kleinen Nagern ermöglichen. Alternativ arbeiten wir an Implantaten, die einen Miniatur-Lichtleiter nutzen, der von roten Laserdioden gespeist wird. Das Endziel ist die Entwicklung von Cochlea-Implantaten für den menschlichen Gebrauch mit 100 Lichtquellen (illustiert im Demonstrator für das optische Cochlea-Implantat, Abb. 3). Diese Sonden werden dann hermetisch versiegelt und ihr Einsatz, ihre Funktionalität und Stabilität in Tierversuchen getestet. In funktionellen Studien messen wir die Zeit-, Frequenz- und Intensitätsauflösung der Schallkodierung mit optischen Mehrkanalimplantaten und vergleichen diese mit dem normalen und dem "elektrischen" Hören. In Zusammenarbeit mit dem Göttinger Röntgenwissenschaftler Tim Salditt und Kollegen analysieren wir die Position und Orientierung der optischen Cochlea-Implantate und ihrer Lichtquellen innerhalb der Cochlea mittels hochauflösender Röntgentomographie (Abb. 4). Weiterhin führen wir mikroskopische Untersuchungen von Innenohr- und Hirngewebe durch, um mögliche Schäden durch die Genfähren, exogene Proteine, optische Stimulation und das Einsetzen der Implantate zu analysieren.
3D-gedruckter menschlicher Demonstrator für das optische Cochlea-Implantat, entwickelt vom Cochlear Optogenetics Program des Göttingen Campus. Ein Sprachprozessor hinter der Ohrmuschel (nicht sichtbar) nimmt die Umgebungsgeräusche über ein Mikrofon auf, wandelt sie um und leitet die Informationen an das Implantat weiter, das wiederum den Hörnerv in der Cochlea über Lichtquellen (hier: blau) stimuliert.
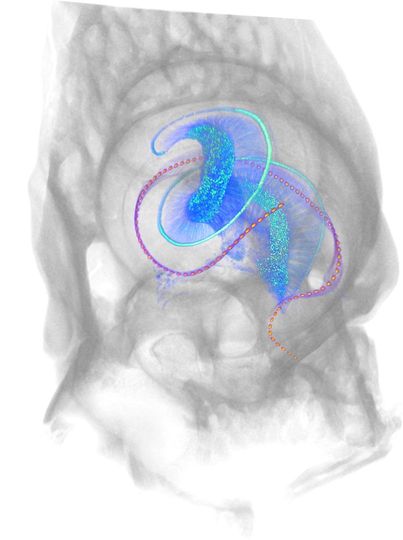 Abbildung 4: Optisches Cochlea-Implantat in einer Maus-Cochlea
Abbildung 4: Optisches Cochlea-Implantat in einer Maus-Cochlea3D-Rendering einer Maus-Cochlea mit der knöchernen Verkapselung (grau) und dem optischen Cochlea-Implantat (magenta), abgebildet mittel Röntgen-Phasenkonstrasttomographie. Das Mikro-LED-basierte Cochlea-Implantat umfasst fast 100 Emitter auf 5 mm Länge, die auf die Spiralganglionneuronen des Hörnervs (blau) zielen. Der Hörnerv und die inneren Haarzellen (cyan, einreihig) sind aus einem Lichtblatt-Fluoreszenzmikroskopie-Bild entnommen. Bildnachweis: Daniel Keppeler und Christian Vogl, Institut für Auditorische Neurowissenschaften.
Keynote-Vortrag von Tobias Moser anlässlich der Verleihung des Grand Prix Scientifique 2020 durch die Fondation Pour l'Audition.





























